Гормональные нарушения могут быть вызваны различными причинами, а их последствия сказываются на функционировании всего организма.
Так и Синдром Уотерхауса-Фредериксена или гипоркортицизм проявляется в деятельности разных систем организма: от кожи до психо-эмоциональной сферы.
Что такое Гипокортицизм?
Гипокортицизм – это общее заболевание, определяемое недостаточной выработкой гормонов коры надпочечников вследствие физической травмы или сбоя гипоталамо-гипофизарной регуляции. Женщины подвержены данному заболеванию чаще, при среднем показателе 7-8 случаем на 100 тысяч населения, среди представительниц женского пола этот показатель в 1,5 раза выше.
Кора надпочечников имеет трехслойное строение, и каждый слой вырабатывает свою группу гормонов:
- Клобучковая зона производит гормоны – минералкортикоиды, к которым относятся дезоксикортикостерон, альдостерон, кортикостерон.
- Пучковая зона секретирует глюкокортикоидные гормоны: кортизон и кортизол.
- Сетчатая зона продуцирует половые гормоны, в частности, андрогены.
При нарушениях происходит сбой во всех зонах, что оказывает общее воздействие на организм.
Сама работа железы подчиняется суточным ритмам: рано утром увеличивается поступление в кровеносное русло кортизола и других глюкокортикоидов, а вечером их уровень сильно снижается. Такой механизм позволяет организму подготовиться к началу нового дня, так же он помогает снизить аллергическую и воспалительную реакцию.
Причины развития заболевания, как правило, носят аутоиммунный характер. Клетки надпочечников начинают восприниматься иммунитетом организма как чужеродные, в результате происходит борьба с ними как с воспалительными, что приводит к их разрушению и невозможности выполнять свои функции. Кроме того, среди причин развития гипокортицизма выделяют:
- нарушения обмена веществ (амилоидоз, гамехроматоз);
- последствие туберкулеза;
- онкологические заболевания;
- хирургическое вмешательство на надпочечниках;
- резкое прекращение лечения гормональными препаратами;
- инфекционные заболевания (сифилис, ВИЧ)
- кровоизлияние в надпочечники.
Этиология и клинические проявления
Первый носит аутоиммунную природу и проявляется в виде отмирания коры надпочечников. За счет нарушения иммунологической толерантности тканей коры развиваются органоспецифические реакции, в кровь попадают антитела, действующие на фермент гидроксилазу – 21 и выступающие в качестве маркеров заболевания.
Гистологической исследование показывает атрофию паренхимы, лимфоидную инфильтрацию, фиброз. Количество клеток, способных производить глюкокортикоиды и минералокортикоиды снижается, что приводит к сокращению их выработки.
Клиническая картина гипокортицизма имеет следующие симптомы:
- сильной слабостью;
- снижение аппетита и нарушением функции пищеварения;
- потерей веса;
- сниженным артериальным давлением;
- изменением вкусовых привычек;
- психосоматическими расстройствами;
- гипогликемией.
Дополнительными признаками выступают:
- гиперпигментация кожи и слизистых оболочек;
- появление депрессии, головных болей;
- обмороки;
- желание есть соленые продукты;
- нарушение половой функции.
Причиной вторичного гипокортицизма является нарушение работы головного мозга, точнее, гипофиза, контролирующего работу надпочечников. В результате снижается иди прекращается синтез АКТГ.
При данной форме заболевание протекает легче, из симптомов проявляются только слабость, пониженное давление и потеря веса. Гиперпигментации не происходит.
Третичный гипокортицизм связан с патологией гипоталамуса и прекращением выработки кортиколиберина, воздействующего на клетки коры надпочечников.
Диагностика заболевания
В крови оценивается уровень содержания кортизола и АКТГ. Для этого используется:
- короткий АКТГ-стимулирующий тест, применяемый при подозрении гипокортицизма у больного;
- продленный АКТГ-стимулирующий тест, актуальный при выявлении заболевания вторичной или третичной формы;
- метирапоновые тесты, используемые, когда есть подозрение на неполный дефицит выработки АКТГ.
Кроме того, для оценки осложнений заболевания применяются:
- рентгенологическое обследование;
- электрокардиограмма;
- спиномозговая пункция.
Получив полную картину заболевания, врач может приступать к лечению.
Лечение и предупреждение болезни
Лечение при гопокортицизме направлено на восстановление нормального обмена веществ в организме, артериального давления и самочувствия пациента. Больному назначается гормон заместительная терапия, включающая прием:
- глюкокортикоидов (гидрокортизона, преднизолона, дексаметазона), применяемых в виде таблеток. Стандартная доза гидрокортизона включает трехразовый прием в течение дня: 10 мг с утра и по 5 – днем и вечером. Преднизолона: 3мг. утром, 2 — вечером;
- минералокортикоидов (флудокортизона);
- дегидроэпиандростерона, положительно влияющего на настроение и общее самочувствие, средняя доза – 20-25 мг. в сутки.
Первоначально лекарство вводятся в виде инъекций, а в дальнейшем больнойначинает принимать таблетки. Доза препаратов должна быть назначена и контролироваться в течение всего лечения врачом. Она подбирается исходя из показателей:
- артериального давления;
- изменения массы тела;
- работы пищеварительной системы;
- общего состояния пациента.
Применяется также симптоматическое лечение. Однако, при правильно подобранной дозировке дополнительные симптомы исчезают через пару недель. Тем не менее, необходимо контролировать результат лечения постоянно с помощью клинических и биохимических методов.
Профилактические меры по борьбе с заболеванием направлены на ведение поддерживающей терапии. Препараты, назначаемые врачом, после нормализации состояния принимаются самостоятельно.
Здоровый образ жизни и регулярные медицинские осмотры также помогают избежать заболевания, вызванного внешними причинами: инфекцией, ишемией, туберкулезом.
Лечение гипокортицизма происходит на протяжении всей жизни. При соблюдении рекомендаций врача и регулярном приеме лекарственных средств наблюдается положительная динамика, и пациент в может вести нормальный образ жизни. Резкий отказ от лекарств может спровоцировать серьезные осложнения, которые способны привести к инвалидности.
Рекомендуем другие статьи по теме
Источник: https://UroHelp.guru/nadpochechniki/gipokorticizm.html
Гиперкортицизм – причины, симптомы, диагностика и лечение
Гиперкортицизм – это заболевание надпочечников, в результате которого значительно повышается уровень кортизола в организме. Эти глюкокортикоидные гормоны принимают непосредственное участие в регулировании обмена вещества и множества физиологических функций.
Надпочечники контролируются гипофизом, посредством выработки адренокортикотропного гормона, который активизирует синтизацию кортизола и кортикостерона.
Что происходит с людьми при данном синдроме, какие причины его возникновения и как лечить заболевания, мы рассмотрим далее в статье.
Гиперкортицизм: что это такое?
Гиперкортицизм или синдром Иценко-Кушинга, представляет собой эндокринную патологию, связанную с продолжительным и хроническим воздействием на организм избыточного количества кортизола.
Такое воздействие может возникать вследствие имеющихся недугов или на фоне приема некоторых медикаментов.
Женщины в 10 раз чаще мужчин страдают гиперкортицизмом, и, в основном, в возрасте от 25 до 40 лет.
Чтобы нормально функционировал гипофиз, необходима достаточная выработка конкретных гормонов гипоталамусом. Если нарушается эта цепочка, то страдает весь организм и это сказывается на состоянии здоровья человека. Впервые клиническая картина эндогенного гиперкортицизма была описана в 1912 г. Гарвеем Кушингом.
Гиперкотицизм проявляется тем, что кортизол в больших количествах замедляет выработку глюкозы, которая очень необходима нашим клеткам. В результате этого, функциональность многих клеток падает и наблюдается атрофирование тканей.
Патогенез
Основу болезни составляет нарушение обратной связи в функциональной системе гипоталамус-гипофиз – кора надпочечников, характеризующееся постоянно высокой активностью гипофиза и гиперплазией кортикотропов или, значительно чаще, развитием АКТГ- продуцирующих аденом гипофиза и гиперплазией коры обоих надпочечников.
В результате этого повышается скорость продукции и суммарная суточная экскреция практически всех фракций кортикостероидов с развитием симптомов гиперкортицизма. В основе синдрома Иценко-Кушинга лежит формирование автономной доброкачественной или злокачественной опухоли надпочечника или дисплазии надпочечника.
Синдром гиперкортицизма приводит к снижению либидо как у женщин, так и у мужчин. У последних он проявляется еще и импотенцией.
Причины
На сегодняшний день медикам не удалось до конца изучить причины, которые влияют на нарушение функции надпочечников. Известно лишь, что при любом факторе, который провоцирует повышение выработки гормонов надпочечниками, развивается заболевание. Провоцирующими факторами гиперкортицизма считаются:
- аденома, возникшая в гипофизе;
- образование опухолей в легких, поджелудочной, бронхиальном дереве, которые продуцируют АКТГ;
- длительный прием глюкокортикоидных гормонов;
- наследственный фактор.
Помимо вышеперечисленных факторов, на возникновение синдрома могут повлиять такие обстоятельства:
- травмирование или сотрясение мозга;
- черепно-мозговые травмы;
- воспаление паутинной оболочки спинного или головного мозга;
- воспалительный процесс в головном мозге;
- менингит;
- кровотечение в субарахноидальное пространство;
- повреждения центральной нервной системы.
Иногда признаки синдрома могут быть вызваны совсем другими факторами, но это только временное явление и не означает, что у человека истинный гиперкортицизм.
Частые причины развития псевдо – синдрома Кушинга – это ожирение, хроническая алкогольная интоксикация, беременность, стресс и депрессия, а иногда даже прием оральных контрацептивов, которые содержат смесь эстрогенов и прогестерона.
Повышение уровня кортизола в крови может произойти даже у грудных детей, когда в их организм вместе с грудным молоком поступает алкоголь.
Виды
Избыточный синтез глюкокортикоидов происходит под влиянием кортикотропина и кортиколиберина или независимо от них. В связи с этим выделяют АКТГ-зависимые и АКТГ-независимые формы патологии. К первой группе относятся:
- Центральный гиперкортицизм.
- АКТГ-эктопический синдром.
В медицине различают три вида гиперкортицизма, которые основываются на разнице причин возникновения патологии:
- экзогенный;
- эндогенный;
- псевдо-синдром.
Во врачебной практике также встречаются случаи юношеского синдрома гиперкортицизма. Юношеский выделен в отдельный вид и обусловлен возрастными гормональными изменениями в организме подростка.
Экзогенный
Под влиянием внешних причин, таких как применение для лечения лекарственных средств, содержащих глюкокортикоиды может развиться ятрогенный или экзогенный гиперкортицизм. В основном он проходит после отмены провоцирующего патологию лекарства.
Эндогенный
Факторами развития эндогенного гиперкортицизма могут быть следующие причины:
- опухоли гипофиза (микроаденома гипофиза);
- бронхов;
- опухоли яичек, яичников;
- опухоль или гиперплазия коры надпочечников.
Провоцирующей опухолью бронхов или половых желез чаще всего бывает эктопированная кортикотропинома. Именно она вызывает повышенную секрецию кортикостероидного гормона.
Псевдо-синдром
Неистинный гиперкортицизм возникает по следующим причинам:
- алкоголизм;
- беременность;
- прием оральных контрацептивов;
- ожирение;
- стрессы или затяжные депрессии.
Наиболее часто причиной псевдо-синдрома становится сильное отравление организма алкоголем. При этом любые опухоли отсутствуют.
Симптомы гиперкортицизма у женщин и мужчин
Клиническая картина гиперкортицизма характеризуется симптомами:
- прогрессирующая слабость;
- постоянная утомляемость;
- бессонница;
- усталость;
- гипотония;
- психическая астения;
- отсутствие аппетита;
- тошнота;
- рвота;
- запоры,
- сменяющиеся поносами;
- боли в животе;
- снижение массы тела.
Патологическое увеличение показателя глюкокортикоидов приводит к появлению синдрома гиперкортицизма.
Пациенты утверждают о жалобах, связанных с изменением внешности и сбоем функционирования сердечно-сосудистой системы, а также костно-мышечной, репродуктивной, нервной систем.
Клинические проявления заболевания также вызваны повышенным содержанием альдостерона и андрогенов, вырабатываемых надпочечников.
Симптомы у женщин
Гиперкортицизм у женщин проявляется следующими симптомами:
- гирсутизмом;
- вирилизацией;
- гипертрихозом;
- сбоем менструальных циклов;
- аменореей и бесплодием.
Самым «популярным» проявлением гиперкортицизма со стороны опорно-двигательного аппарата является остеопороз (он обнаруживается у 90 % людей, страдающих синдромом).
Данная патология имеет свойство прогрессировать: сначала она дает знать о себе болью в суставах и костях, а затем – переломами рук, ног и ребер.
Если остеопорозом страдает ребенок, у него наблюдается отставание от сверстников в росте.
Признаки у мужчин
Мужской гиперкортицизм проявляется проблемами в половой системе: снижением потенции и либидо, атрофией яичек и гинекомастией. Так же, гиперкотицизм может проявить себя сбоями нервной и сердечно-сосудистой систем.
“Нервные” симптомы:
- психозы и стрессы;
- смена эйфорического состояния депрессией;
- заторможенность;
- суициидальные попытки.
Сердечно-сосудистые симптомы:
- аритмия сердца;
- артериальная гипертония;
- сердечная недостаточность.
Кожа у пациентов имеет характерный «мраморный» оттенок с хорошо заметным сосудистым рисунком, склонна к шелушению, сухости, перемежается с участками потливости.
На коже плечевого пояса, молочных желез, живота, ягодиц и бедер образуются полосы растяжения кожи – стрии багровой или цианотичной окраски, длиной от нескольких миллиметров до 8 см и шириной до 2 см.
Наблюдаются кожные высыпания (акне), подкожные кровоизлияния, сосудистые звездочки, гиперпигментация отдельных участков кожи.
Негативно сказывается синдром на гормональном фоне пациента, наблюдается нестабильное эмоциональное состояние: депрессия чередуется с эйфорией и психозом.
Осложнения
Одним из самых опасных осложнений гиперкортицизма является адренолиновый криз, который проявляется:
- нарушением сознания;
- рвотой и высоким давлением;
- гиперкалиемией;
- гипонатриемией;
- гипогликемией;
- болями в животе;
- метаболическим ацидозом.
Синдром Кушинга, который перешел в хроническую форму способен привести к гибели человека, поскольку провоцирует ряд тяжелых осложнений, а именно:
- декомпенсация сердца;
- инсульт;
- сепсис;
- пиелонефрит тяжелой степени;
- недостаточность почек хронической формы;
- остеопороз, при котором происходят многочисленные переломы позвоночника.
Диагностика
Для диагностики данного заболевания используют следующие методы:
- анализ крови на адренокортикотропный гормон и кортикостероиды;
- гормональные пробы мочи;
- рентген головы, костей скелета;
- МРТ или КТ головного мозга.
Диагноз ставится четко при наличии всех исследований. Его следует дифференцировать с сахарным диабетом и ожирением.
Ни один из лабораторных диагностических тестов на гипер-кортизолизм нельзя считать абсолютно надёжным, поэтому часто рекомендуют их повторять и комбинировать. Диагноз гиперкортицизма устанавливают на основании повышенной экскреции свободного кортизола с мочой или нарушенной регуляции гипоталамо-гипофизарно-надпочечниковой системы:
- суточная экскреция свободного кортизола и 17-гидроксикортикостерона повышена;
- суточный биоритм секреции кортизола отсутствует;
- содержание кортизола в 23—24 ч повышено.
Исследования в амбулаторных условиях
- Свободный кортизол в суточной моче. Доля ложноотрицательных результатов в этом тесте достигает 5-10%, поэтому исследование рекомендуют проводить 2—3 раза. Ложноположительные результаты также провоцируют приём фенофибрата, карбамазепина и дигоксина, а ложноотрицательные результаты возможны при сниженной клубочковой фильтрации (
Источник: https://travmatolog.net/giperkortitsizm/
Синдром Иценко-Кушинга (гиперкортицизм)
Синдром Иценко-Кушинга – патологический симптомокомплекс, возникающий вследствие гиперкортицизма, т. е. повышенного выделения корой надпочечников гормона кортизола либо длительного лечения глюкокортикоидами.
Следует отличать синдром Иценко-Кушинга от болезни Иценко-Кушинга, под которой понимают вторичный гиперкортицизм, развивающийся при патологии гипоталамо-гипофизарной системы. Диагностика синдрома Иценко–Кушинга включает исследование уровня кортизола и гипофизарных гормонов, дексаметазоновую пробу, МРТ, КТ и сцинтиграфию надпочечников. Лечение синдрома Иценко–Кушинга зависит от его причины и может заключатся в отмене глюкокортикоидной терапии, назначении ингибиторов стероидогенеза, оперативном удалении опухоли надпочечников.
Синдром Иценко-Кушинга – патологический симптомокомплекс, возникающий вследствие гиперкортицизма, т. е. повышенного выделения корой надпочечников гормона кортизола либо длительного лечения глюкокортикоидами.
Глюкокортикоидные гормоны участвуют в регуляции всех видов обмена веществ и многих физиологических функций. Работу надпочечников регулирует гипофиз путем секреции АКТГ — адренокортикотропного гормона, активизирующего синтез кортизола и кортикостерона.
Деятельностью гипофиза управляют гормоны гипоталамуса — статины и либерины.
Такая многоступенчатая регуляция необходима для обеспечения слаженности функций организма и обменных процессов.
Нарушение одного из звеньев этой цепи может вызвать гиперсекрецию глюкокортикоидных гормонов корой надпочечников и привести к развитию синдрома Иценко-Кушинга.
У женщин синдром Иценко-Кушинга встречается в 10 раз чаще, чем у мужчин, развиваясь, преимущественно, в возрасте 25-40 лет.
Различают синдром и болезнь Иценко-Кушинга: последняя клинически проявляется той же симптоматикой, но в ее основе лежит первичное поражение гипоталамо-гипофизарной системы, а гиперфункция коры надпочечников развивается вторично. У пациентов, страдающих алкоголизмом или тяжелыми депрессивными расстройствами, иногда развивается псевдо-синдром Иценко-Кушинга.
Синдром Иценко-Кушинга (гиперкортицизм)
Синдром Иценко-Кушинга – широкое понятие, включающее комплекс различных состояний, характеризующихся гиперкортицизмом.
Согласно современным исследования в области эндокринологии более 80% случаев развития синдрома Иценко-Кушинга связано с повышенной секрецией АКТГ микроаденомой гипофиза (болезнь Иценко-Кушинга).
Микроаденома гипофиза представляет небольшую (не более 2 см), чаще доброкачественную, железистую опухоль, продуцирующую адренокортикотропный гормон.
У 14-18% пациентов причиной синдрома Иценко-Кушинга является первичное поражение коры надпочечников в результате гиперпластических опухолевых образований коры надпочечников – аденомы, аденоматоза, аденокарциномы.
1-2% заболевания вызывается АКТГ-эктопированным или кортиколиберин-эктопированным синдромом – опухолью, секретирующей кортикотропный гормон (кортикотропиномой).
АКТГ-эктопированный синдром может вызываться опухолями различных органов: легких, яичек, яичников, тимуса, околощитовидных, щитовидной, поджелудочной, предстательной железы.
Частота развития лекарственного синдром Иценко-Кушинга зависит от правильности применения глюкокортикоидов в лечении пациентов с системными заболеваниями.
Гиперсекреция кортизола при синдроме Иценко-Кушинга вызывает катаболический эффект — распад белковых структур костей, мышц (в том числе и сердечной), кожи, внутренних органов и т. д., со временем приводя к дистрофии и атрофии тканей. Усиление глюкогенеза и всасывания в кишечнике глюкозы вызывает развитие стероидной формы диабета.
Нарушения жирового обмена при синдроме Иценко-Кушинга характеризуется избыточным отложением жира на одних участках тела и атрофией на других ввиду их разной чувствительности к глюкокортикоидам.
Влияние избыточного уровня кортизола на почки проявляется электролитными расстройствами – гипокалиемией и гипернатриемией и, как следствие, повышением артериального давления и усугублением дистрофических процессов в мышечной ткани.
В наибольшей степени от гиперкортицизма страдает сердечная мышца, что проявляется в развитии кардиомиопатии, сердечной недостаточности и аритмий.
Кортизол оказывает угнетающее действие на иммунитет, вызывая у пациентов с синдромом Иценко-Кушинга склонность к инфекциям.
Течение синдрома Иценко-Кушинга может быть легкой, средней и тяжелой формы; прогрессирующим (с развитием всего симптомокомплекса за 6-12 месяцев) или постепенным (с нарастанием в течение 2-10 лет).
Наиболее характерным признаком синдрома Иценко-Кушинга служит ожирение, выявляемое у пациентов более чем в 90% случаев. Перераспределение жира носит неравномерный характер, по кушингоидному типу.
Жировые отложения наблюдаются на лице, шее, груди, животе, спине при относительно худых конечностях («колосс на глиняных ногах»). Лицо становится лунообразным, красно-багрового цвета с цианотичным оттенком («матронизм»).
Отложение жира в области VII шейного позвонка создает, так называемый, «климактерический» или «бизоний» горб. При синдроме Иценко-Кушинга ожирение отличает истонченная, почти прозрачная кожа на тыльных сторонах ладоней.
Со стороны мышечной системы наблюдается атрофия мышц, снижение тонуса и силы мускулатуры, что проявляется мышечной слабостью (миопатией). Типичными признаками, сопровождающими синдром Иценко-Кушинга, являются «скошенные ягодицы» (уменьшение объема бедренных и ягодичных мышц), «лягушачий живот» (гипотрофия мышц живота), грыжи белой линии живота.
Кожа у пациентов с синдромом Иценко-Кушинга имеет характерный «мраморный» оттенок с хорошо заметным сосудистым рисунком, склонна к шелушению, сухости, перемежается с участками потливости.
На коже плечевого пояса, молочных желез, живота, ягодиц и бедер образуются полосы растяжения кожи – стрии багровой или цианотичной окраски, длиной от нескольких миллиметров до 8 см и шириной до 2 см.
Наблюдаются кожные высыпания (акне), подкожные кровоизлияния, сосудистые звездочки, гиперпигментация отдельных участков кожи.
При гиперкортицизме нередко развивается истончение и повреждение костной ткани — остеопороз, ведущий к сильным болезненным ощущениям, деформации и переломам костей, кифосколиозу и сколиозу, более выраженных в поясничном и грудном отделах позвоночника. За счет компрессии позвонков пациенты становятся сутулыми и меньше ростом. У детей с синдромом Иценко-Кушинга наблюдается отставание в росте, вызванное замедлением развития эпифизарных хрящей.
Нарушения со стороны сердечной мышцы проявляются в развитии кардиомиопатии, сопровождающейся аритмиями (фибрилляцией предсердий, экстрасистолией), артериальной гипертензией и симптомами сердечной недостаточности.
Эти грозные осложнения способны привести к гибели пациентов.
При синдроме Иценко-Кушинга страдает нервная система, что выражается в ее нестабильной работе: заторможенности, депрессиях, эйфории, стероидных психозах, суицидальных попытках.
В 10-20% случаев в ходе заболевания развивается стероидный сахарный диабет, не связанный с поражениями поджелудочной железы. Протекает такой диабет довольно легко, с длительным нормальным уровнем инсулина в крови, быстро компенсируется индивидуальной диетой и сахароснижающими препаратами. Иногда развиваются поли- и никтурия, периферические отеки.
Гиперандрогения у женщин, сопровождающая синдром Иценко-Кушинга, вызывает развитие вирилизации, гирсутизма, гипертрихоза, нарушений менструального цикла, аменореи, бесплодия. У пациентов-мужчин наблюдаются признаки феминизации, атрофия яичек, снижение потенции и либидо, гинекомастия.
Хроническое, прогрессирующее течение синдрома Иценко-Кушинга с нарастающей симптоматикой может приводить к гибели пациентов в результате осложнений, несовместимых с жизнью: декомпенсации сердечной деятельности, инсультов, сепсиса, тяжелого пиелонефрита, хронической почечной недостаточности, остеопороза с множественными переломами позвоночника и ребер.
Неотложным состоянием при синдроме Иценко-Кушинга является адреналовый (надпочечниковый) криз, проявляющийся нарушением сознания, артериальной гипотензией, рвотой, болями в животе, гипогликемией, гипонатриемией, гиперкалиемией и метаболическим ацидозом.
В результате снижения резистентности к инфекциям у пациентов с синдромом Иценко-Кушинга нередко развиваются фурункулез, флегмоны, нагноительные и грибковые заболевания кожи.
Развитие мочекаменной болезни связано с остеопорозом костей и выделением с мочой избытка кальция и фосфатов, приводящих к образованию оксалатных и фосфатных камней в почках.
Беременность у женщин с гиперкортицизмом часто заканчивается выкидышем или осложненными родами.
При подозрении у пациента синдрома Иценко-Кушинга на основании амнестических и физикальных данных и исключении экзогенного источника поступления глюкокортикоидов (в т. ч. ингаляционного и внутрисуставного), в первую очередь выясняется причина гиперкортицизма. Для этого используется скрининговые тесты:
- определение экскреции кортизола в суточной моче: повышение кортизола в 3–4 раза и более свидетельствует о достоверности диагноза синдрома или болезни Иценко–Кушинга.
- малую дексаметазоновую пробу: в норме прием дексаметазона снижает уровень кортизола более чем в половину, а при синдроме Иценко-Кушинга снижения не происходит.
Дифференциальную диагностику между болезнью и синдромом Иценко-Кушинга позволяет провести большая дексаметазоновая проба. При болезни Иценко-Кушинга прием дексаметазона приводит к снижению концентрации кортизола более чем в 2 раза от исходного; при синдроме снижения кортизола не происходит.
В моче повышено содержание 11-ОКС (11-оксикетостероидов) и снижено 17-КС. В крови гипокалиемия, увеличение количества гемоглобина, эритроцитов и холестерина.
Для определения источника гиперкортицизма (двусторонняя гиперплазия надпочечников, аденома гипофиза, кортикостерома) проводится МРТ или КТ надпочечников и гипофиза, сцинтиграфия надпочечников. С целью диагностики осложнений синдрома Иценко-Кушинга (остеопороза, компрессионных переломов позвонков, перелома ребер и т. д.
) проводится рентгенография и КТ позвоночника, грудной клетки. Биохимическое исследование показателей крови диагностирует электролитные нарушения, стероидный сахарный диабет и др.
При ятрогенной (лекарственной) природе синдрома Иценко-Кушинга необходима постепенная отмена глюкокортикоидов и замена их на другие иммунодепрессанты. При эндогенной природе гиперкортицизма назначаются препараты, подавляющие стероидогенез (аминоглютетимид, митотан).
При наличии опухолевого поражения надпочечников, гипофиза, легких проводится хирургическое удаление новообразований, а при невозможности – одно- или двусторонняя адреналэктомия (удаление надпочечника) или лучевая терапия гипоталамо-гипофизарной области. Лучевую терапию часто проводят в комбинации с хирургическим или медикаментозным лечением для усиления и закрепления эффекта.
Симптоматическое лечение при синдроме Иценко-Кушинга включает применение гипотензивных, мочегонных, сахароснижающих препаратов, сердечных гликозидов, биостимуляторов и иммуномодуляторов, антидепрессантов или седативных средств, витаминотерапию, лекарственную терапию остеопороза. Проводится компенсация белкового, минерального и углеводного обмена. Послеоперационное лечение пациентов с хронической надпочечниковой недостаточностью, перенесших адреналэктомию, состоит в постоянной заместительной гормональной терапии.
При игнорировании лечения синдрома Иценко-Кушинга развиваются необратимые изменения, приводящие к летальному исходу у 40-50% пациентов.
Если причиной синдрома явилась доброкачественная кортикостерома, прогноз удовлетворительный, хотя функции здорового надпочечника восстанавливаются только у 80% пациентов.
При диагностике злокачественных кортикостером прогноз пятилетней выживаемости – 20-25% (в среднем 14 месяцев). При хронической надпочечниковой недостаточности показана пожизненная заместительная терапия минерало- и глюкокортикоидами.
В целом прогноз синдрома Иценко-Кушинга определяется своевременностью диагностики и лечения, причинами, наличием и степенью выраженности осложнений, возможностью и эффективностью оперативного вмешательства. Пациенты с синдромом Иценко-Кушинга находятся на динамическом наблюдении у эндокринолога, им не рекомендуются тяжелые физические нагрузки, ночные смены на производстве.
Источник: https://www.KrasotaiMedicina.ru/diseases/zabolevanija_endocrinology/hypercorticoidism
Гипотиреоз
Гипотиреоз — эндокринное заболевание, для которого характерно снижение функций щитовидной железы, а также понижение выработки ею гормонов. Крайней степенью проявления у взрослых пациентов является микседема, а у детей — кретинизм. Обусловлена болезнь может быть как патологическими нарушениями, которые воздействуют на гормональный обмен, так и недостатком гормонов щитовидной железы.
Содержание статьи:
В зависимости от возникновения и сложности заболевания его классифицируют на несколько видов.
По степени тяжести выделяют такие формы гипотиреоза:
- латентный или субклинический: характерным его признаком является повышение уровня ТГГ (тиреотропного гормона);
- манифесетный: происходит гиперсекреция ТТГ;
- компенсированный;
- декомпенсированный;
- осложненный: самая сложная степень заболевания, при которой проявляются такие симптомы, как вторичная аденома гипофиза, сердечная недостаточность, кретинизм. Как правило, эту форму заболевания обнаруживают, когда болезнь на протяжение длительного времени не лечили и она находится в запущенной стадии.
В зависимости от причин возникновения патологии различают такие ее формы:
- Врожденный гипотиреоз. Диагностируется в случае отсутствия или недостаточного развития щитовидной железы. Встречается также наследственное нарушение ферментов, которые участвуют в синтезе гормонов щитовидной железы.
- Приобретенный гипотиреоз. Эта форма заболевания возникает чаще всего после резекции щитовидной железы. Причиной патологии могут стать облучение органов шеи, воздействие радиации, воспаление щитовидной железы, возникновение опухолей на ней, применение таких медикаментов, как йодиды, препараты лития, витамин А (в случае его передозировки).
Классифицируют гипотиреоз также на такие виды:
- первичный (возникает из-за проблем в работе щитовидной железы);
- вторичный (недостаточная выработка гипоталамусом тиролиберина);
- третичные (причиной этого заболевания становится низкая выработка гипоталамусом тиролиберина);
- периферические (причиной болезни становится резкое снижение чувствительности тканей организма и рецепторов клеток к воздействию трийодтиронина и тироксина.
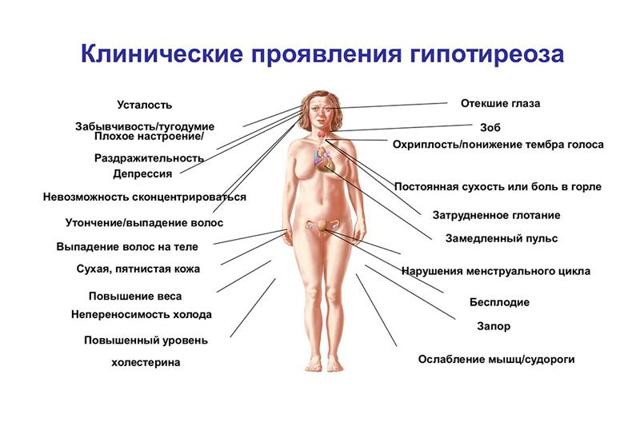
Симптомы гипотиреоза
Диагностировать заболевание крайне сложно по нескольким причинам. Во-первых, диагностированию заболевания мешает отсутствие каких-либо специфических симптомов.
Во-вторых, многие симптомы гипотиреоза очень похожи на признаки других хронических психических и соматических болезней. В целом, для клинической картины гипотиреоза характерна полисистемность проявлений.
Однако у некоторых больных все же проявляются некоторые специфические симптомы заболевания:
- ощущение дискомфорта и боли в зоне шее;
- истончение кожи;
- повышение потливости и температуры тела;
- расслоение ногтей и истончение локонов;
- сокращение объема легких, а также одышка;
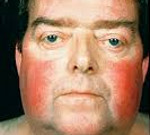
- экзофтальм (увеличение в размерах, а также выпячивание глаз), отечность век без нарушения движения глаз;
- проблемы с сердечными функциями: повышение артериального давления, тахикардия, аритмия, сердечная недостаточность;
- повышенная утомляемость;
- у мужчин может наблюдаться снижение полового влечения, а у женщин — различные нарушения менструаций;
- часто повторяющиеся позывы к мочеиспусканию;
- повышение в крови уровня сахара, которое приводит к появлению тиреогенного диабета;
- расстройство аппетита, рвота, диарея и тошнота, которые становятся причинами резкого снижения веса;
- больные также жалуются на озноб, внутреннюю дрожь и жар в теле.
Диагностика гипотиреоза
Гипотиреоз щитовидной железы диагностируют по клиническим симптомам его проявления, а также анализам пациента. А именно, в первую очередь проверяют уровень Т3 и Т4 в крови, которые при наличии заболевания повышаются.
В некоторых случаях повышение уровня данных гормонов свидетельствует о высокой чувствительности к ним тканей.
При этом наблюдается, что при первичном гипертиреозе уровень тиреотропного гормона понижается, а при вторичном напротив повышается.
Также проводят пробы с радиоактивным йодом. Если всасывание йода щитовидной железой повышено, это свидетельствует об активизации выработки Т3 и Т4. Напротив, понижение продукции этих гормонов может говорить о развитии таких заболеваний, как опухоли или тиреоидиты. О наличии аутоиммунных процессов могут свидетельствовать антитела к антигенам щитовидной железы.
Применяют для диагностики гипертиреоза также ультразвуковое обследование. Во время него определяются размеры щитовидной железы и наличие на ней узлов и других патологических образований.
Уточнить место формирования таких узлов, а также их размеры поможет компьютерная томография. Показано при заболевании также ЭКГ, которое определяет наличие или отсутствие отклонений в функционировании сердечно-сосудистой системы.
При необходимости для уточнения диагноза также могут назначить биопсию узлов щитовидный железы и ее сцинтиграфию.
Стоит отметить, что гипертиреоз может протекать в самых разных формах, а также проявляться по-разному у мужчин, женщин и детей. Что касается форм заболевания, то к ним относятся следующие:
- Субклинический гипертиреоз. Для этой формы заболевания характерным является низкий уровень ТТГ (тиреотропного гормона) и нормальное содержание в крови гормонов Т3 и Т4. Зачастую протекает заболевание без видимых симптомов. Обнаруживается эта форма гипертиреоза чаще всего у пожилых людей. Поскольку патология оказывает негативное воздействие на сердечную деятельность больных, им назначается терапия, направленная на предотвращение развития сердечно-сосудистых заболеваний.
- Аутоиммунный гипертиреоз. Это такое воспалительное заболевание, при котором в организме образовываются антитела, которые наносят вред собственным клеткам щитовидной железы. Возникает данная патология зачастую в самом начале заболевания. Для аутоиммунного гипертиреоза характерен сначала резкий выброс гормонов в кровь, а затем снижение их концентрации. На фоне патологии может развиваться гипертиреоз или гипотиреоз.
Осложнения гипотиреоза
Разумеется, данное заболевание необходимо диагностировать на его ранней стадии развития, так как только в этом случае можно прогнозировать успешное и легкое лечение гипотиреоза. Из-за несвоевременного диагностирования гипертиреоза, его неблагоприятного течения, стресса, инфекционных заболеваний, чрезмерных физических нагрузок может возникнуть тиреотоксический криз.
Встречается данное осложнение исключительно у женщин. Характеризуется оно внезапным обострением всех симптомов патологии. А именно, к осложнениям заболевания относятся резкая тахикардия, лихорадка, бред. Кроме того, криз может прогрессировать вплоть до коматозного состояния или даже до летального исхода.
Возможен также и такой вариант осложнения, когда пациентка чувствует полное равнодушие ко всему и апатию.
Лечение гипотиреоза
Гипотиреоз — сложное эндокринное заболевание, к лечению которого нужно подходить комплексно. На сегодняшний день в эндокринологии используется несколько методов лечения, которые могут применяться как по отдельности, так и комплексно друг с другом.
А именно, к методикам лечения гипертиреоза относятся радиойодная терапия, операции по удалению части или всей железы, медикаментозная (консервативная терапия). Сложно сказать, какой именно из этих методов лучше всего, поскольку выбор той или иной методики обусловлен прежде всего особенностями конкретного случая.
Выбор метода лечения болезни осуществляется в зависимости от следующих факторов: причины возникновения патологии, возраста больного, тяжести заболевания, аллергии на лекарственные препараты.
- Консервативное лечения гипертиреоза
- Лечение радиоактивным йодом
- Хирургические методы лечения
- Альтернативные методы
Основой медикаментозного лечения заболевания являются антитиреоидные препараты. Однако применяют их только, если наблюдается небольшое увеличение щитовидной железы — не больше 40 мл. Если же диагностировано гораздо большее увеличение железы, то медикаментозная терапия применяется для подготовки к операции. Наиболее часто применяемыми антитиреоидными препаратами являются медикаменты из группы тионамидов. Все эти медикаменты направлены на подавление образования и развития гормонов щитовидной железы.
Медикаментозная терапия при гипертиреозе проводится по следующему принципу. Сначала назначают высокие дозы лекарств — не меньше 30-50 мг по два раза на день. Высокие дозы медикаментов показаны для нормализации эутиреоза. При этом во время терапии периодически назначают анализы на уровень гормонов в крови.
Чтобы достичь состояния эутиреоза, необходимо пройти курс лечения в течение 4-6 недель. Когда функции щитовидной железы придут в норму, назначается поддерживающая терапия. Для этого обычно выбирают курс тиамзола с периодичностью по 10 мг один раз на день.
Такое поддерживающее лечение рекомендовано проводить в течение одного года, так как у более 30% больных наблюдается ремиссия заболевания.
Негативные последствия медикаментозного лечения
Стоит отметить, что в процессе медикаментозного лечения у некоторых больных могут быть обнаружены побочные эффекты.
К наиболее распространенным из них относятся аллергические реакции (дерматит, отек Квинке, крапивница), а также снижение уровня лейкоцитов и тромбоцитов в крови (тромбоцитопения, агранулоцитоз).
При особо тяжелых формах заболевания нередко назначают карбимазол, который оказывает пролонгированное действие. Карбимазол оказывает эффективное воздействие на щитовидную железу, а также способствует превращению гормона Т4 в Т3.
Немедикаментозная терапия
Важная роль в консервативном лечении пациентов также отводится немедикаментозным терапевтическим методикам, в особенности — водолечению и диетотерапии.
Больным с гипертиреозом назначается санаторное лечение, в котором особенное внимание уделяется профилактике заболеваний сердечно-сосудистой системы.
Также важно придерживаться определенной диеты: потреблять достаточное количество БЖУ, витаминов, минеральных солей, а также ограничить употребление кофе, чая, пряностей и шоколада.
Методика лечения гипотиреоза радиоактивным йодом считается одной из наиболее эффективных. Радиоактивный йод способен очень быстро всасываться в щитовидную железу, а также накапливаться в ней, что приводит к быстрому уменьшению ее размеров. Распад йода приводит к разрушению клеток щитовидной железы. Принимают данное средство в виде натриевой соли. Стоит отметить высокую эффективность этой методики лечения, поскольку ремиссия наступает более чем в 90% случаев.
Если диагностируется тяжелая степень заболевания, может быть назначено хирургическое лечение. А именно, показаниями к резекции щитовидной железы являются увеличение размеров зоба, аллергия на антитиреоидные медикаменты, рецидив заболевания после прохождения медикаментозной терапии. В таких случаях рекомендована субтотальная резекция железы, при которой оставляют не менее 3 миллиметров ткани. Перед хирургическим вмешательством пациент должен пройти подготовительную терапию. Также медикаментозное лечение назначают и после операции, чтобы предупредить возникновение гипотиреоза.
Для лечения патологии могут применять и альтернативные методики, в частности ß-адреноблокаторы, которые блокируют воздействие на организм тиреоидных гормонов. После проведения подобной процедуры пациент чувствует себя лучше уже через несколько часов. Наиболее используемыми ß-адреноблокаторами являются метопролол, атенолол, индерал-ла, надолол. Однако стоит при этом отметить, что все эти медикаментозные препараты не могут применяться в качестве основного метода лечения. Используют их исключительно в сочетании с другими методиками.
Прогноз при гипотиреозе
Крайне важно выявить заболевание на ранней его стадии, поскольку только тогда можно будет надеяться на благоприятный прогноз его лечения.
Тяжелая степень гипотиреоза может вызывать ряд осложнений, в том числе психоз, гипотиреоидную кому, накопление в серозных полостях жидкости.
У больных гипотиреозом также наблюдается повышенная склонность к заболеванию атеросклерозом. Наиболее тяжелые формы болезни требует комплексного длительного лечения.
Даже не смотря на наличие осложнений, прогноз для больного может оказаться благоприятным, поскольку большинство из них поддаются терапии.
К сожалению, при врожденном гипотиреозе прогноз для психического здоровья пациента очень неблагоприятный. Поэтому лечение тиреоидными медикаментами необходимо начать в течение первого года жизни больного.
Однако если был диагностирован кретинизм, терапия тиреоидными препаратами поможет только немного улучшить психическое здоровье пациента.
Профилактика гипотиреоза
Существуют определенные факторы риска, которые могут повлиять на возникновение и развитие заболевания. А именно, в группе риска находятся больные на аутоиммунные заболевания, а также люди, перенесшие инфекции, психические травмы и стрессы.
Что касается профилактики гипотиреоза, то к ней прежде всего можно отнести йодную терапию, которая может быть индивидуальной, массовой и групповой. Наиболее эффективной считается массовая йодная профилактика, которая предусматривает внесение солей йода в такие распространенные продукты питания, как вода, соль и хлеб.
Исследования свидетельствуют о том, что регулярное употребление в пищу 100-150 мкг йода приводит к снижению вероятности развития заболевания на 50-65%.
Индивидуальная йодная профилактика базируется на использовании пищевых добавок и лекарств, которые содержат в составе большое количество йода.
Что касается групповой профилактики, то она предусматривает прием содержащих йод препаратов отдельными группами населения, которые находятся в группе риска.
А именно, групповая профилактика показана подросткам, детям, беременным, а также кормящим женщинам.
Наиболее эффективным методом йодной профилактики считается употребление в пищу поваренной соли с добавлением йода. Сегодня в этих целях применяется соль с содержанием йодата калия 40 ± 15 мг на один килограмм.
Основные преимущества данного вещества состоят в том, что оно не улетучивается даже при длительном хранении соли, не меняет цвет и вкус продуктов, что очень важно при их засолке. К тому же, йодат калия не улетучивается даже во время термической обработки продуктов питания.
Срок хранения йодированной соли составляет 9-12 месяцев.
Кроме того, для устранения дефицита йода можно добавлять в рацион питания такие продукты, как хлеб, масло, конфеты, молоко, кондитерские изделия. Стоит обратить внимание и на условия усвояемости йода организмом. А именно, полноценное усвоение вещества возможно только при достаточном содержании в рационе железа, белка, цинка, витаминов Е и А.
Для профилактики гипотиреоза крайне важно ввести в рацион продукты, богатые йодом. К ним в первую очередь относятся шпинат, свекла, салат, морская капуста.
При этом рекомендуется приобретать ламинарию в сухом виде, чтобы затем применять ее в качестве приправы к еде или же разводить в стакане воды, после чего добавляя к пище. В качестве общеукрепляющих средств показаны витаминно-питательные смеси на основе орехов, лимонов и меда.
Помимо коррекции питания следует сосредоточить внимание и на нормализации психического здоровья, поскольку щитовидная железа очень остро реагирует на нервное перенапряжение, стресс, бессонницу и эмоциональные срывы.
Источник: https://www.mosmedportal.ru/illness/gipotireoz/
Гипокортицизм
Синдром гипокортицизма (хроническая недостаточность коры надпочечников) обусловлен недостаточной секрецией гормонов коры надпочечников при повреждении (первичный гипокортицизм) или нарушениях гипоталамо-гипофизарной регуляции (вторичный и третичный гипокортицизм).
Гормоны, которые синтезируются в корковом веществе надпочечников, относятся к кортикостероидам. Сама кора надпочечников морфо-функционально состоит из трёх слоёв (зон), каждая из которых продуцирует определенный вид гормонов:
- Клубочковая зона — отвечает за производство гормонов, называемых минералкортикоидами (альдостерон, кортикостерон, дезоксикортикостерон).
- Пучковая зона — отвечает за производство гормонов, называемых глюкокортикоидами (кортизол, кортизон)
- Сетчатая зона — отвечает за производство половых гормонов (андрогены).
Этиология и патогенез
Первичный гипокортицизм (болезнь Аддисона).
Предрасполагающие факторы — аутоиммунные заболевания различного характера с вовлечением в процесс коры надпочечников, туберкулезный процесс, амилоидоз, ВИЧ-инфекция, сифилис и грибковые заболевания.
Причиной гипокортицизма могут быть метастазы раковых опухолей. Наследственная предрасположенность реализуется через нарушения системе иммунного контроля. Имеется ассоциация с антигенами системы HLAB8 и DW3, DR3, A1.
В основе первичного гипокортицизма лежит атрофия коры надпочечников, чаще всего как следствие аутоиммунного процесса (аутоиммунный адреналит).
При этом нарушается иммунологическая толерантность к ткани коры, которая сопровождается развитием органоспецифических реакций. Тканевую специфичность определяют антигены, содержащиеся в клеточных структурах коры надпочечников.
При попадании их в кровь образуются антитела к ключевому ферменту стероидогенеза — 21-гидроксилазе, которые служат специфическими маркерами заболевания.
При гистологическом исследовании в коре надпочечников выявляются атрофия паренхимы, фиброз, лимфоидная инфильтрация, преимущественно и клубочковой или пучковой зонах. В связи с этим уменьшается число клеток, продуцирующих глюкокортикоиды (кортизол) и минералокортикоиды (альдостерон).
Вторичный гипокортицизм. Вторичная недостаточность коры надпочечников развивается при опухолях головного мозга, после перенесенных операций, травматических повреждений мозга, при аутоиммунном гипофизите, тромбозе кавернозного синуса, после массивных кровотечений. В основе патогенеза — недостаточная секреция кортикотропина.
Обычно сочетается с недостаточностью других тропных гормонов гипофиза (гонадотропины, тиротропин). При длительном лечении глюкокортикоидными препаратами различных заболеваний также развивается вначале вторичная недостаточность коры надпочечников с угнетением секреции кортикотропина по закону обратной связи.
Длительная терапия может привести к атрофии коры надпочечников.
Третичный гипокортицизм возникает при уменьшении секреции кортиколиберина вследствие опухоли или ишемии гипоталамической области, после лучевой терапии, операций, при нервной анорексии, интоксикации.
Симптомы
Ранние признаки: утомляемость и слабость во второй половине дня, повышенная чувствительность к действию солнечных лучей со стойким загаром, снижение резистентности к инфекциям и затяжное течение простудных заболеваний, ухудшение аппетита.
Развернутая клиническая симптоматика весьма типична и характеризуется пигментацией кожи и слизистых оболочек от золотистого до сероватого оттенков, особенно в местах трения (подмышечные впадины, паховая область, кисти и локти, губы и слизистая оболочка полости рта, рубцы и шрамы). Отмечаются стойкая артериальная гипотензия, тахикардия, диспептические расстройства, боли в животе, похудание, резкая мышечная слабость, затрудняющая передвижение даже медленным шагом.
Специфические признаки: повышенная потребность в соли и склонность к гипогликемическим реакциям.
Клинические симптомы обусловлены недостатком глюкокортикоидов (мышечная слабость, диспептические расстройства, похудание, гипогликемия), минералокортикоидов (потребность в соленой пище, артериальная гипотензия) и повышенной секрецией меланоцитотропина (проопиомеланокортина). Выраженные клинические признаки развиваются при повреждении более 80% ткани коры надпочечников.
Первичный гипокортицизм может сочетаться с кандидозом, гипотиреозом, аутоиммунным тиреоидитом, токсическим зобом, сахарным диабетом 1-го типа. При вторичном и третичном гипокортицизме клиническая симптоматика менее выражена, пигментации, как правило, нет. Четкие признаки заболевания могут появиться только при стрессовых ситуациях.
Диагностика
Диагностические критерии: пигментация, похудание, артериальная гипотензия (особенность которой — неадекватная реакция на физическую нагрузку в виде снижения АД), снижение содержания кортизола в плазме крови (< 100 нмоль /л), повышение уровня калия (> 5 ммоль/л), снижение уровня натрия в сыворотке крови (< 130 ммоль/л), высокий титр антител к 21-гидроксилазе, гипогликемия, повышение содержания кортикотропина > 100 нг/мл при первичном гипокортицизме и снижение его при вторичном.
В начальных стадиях для верификации диагноза применяются функциональные пробы: проба с синактеном-депо (синтетический аналог кортикотропина пролонгированного действия).
Методика пробы следующая: внутримышечно вводится 1 мг препарата после забора крови для исследования базального уровня кортизола. Повторное исследование крови на содержание кортизола проводится через-24 ч.
Признаком первичного гипокортицизма считается отсутствие повышения содержания кортизола в крови после стимуляции синактеном. При вторичном гипокортицизме концентрация кортизола заметно возрастает.
Тест с длительной стимуляцией надпочечников синактеном-депо проводится внутримышечно ежедневно в течение 5 дней в дозе 1 мг. Свободный кортизол в суточной моче определяют как до введения препарата, так и в течение 1-го, 3-го и 5-го дней стимуляции коры надпочечников.
У здоровых людей содержание свободного кортизола в суточной моче увеличивается в 3—5 раз от исходного уровня.
При вторичной недостаточности, напротив, в 1-й день стимуляции синактеном-депо может не произойти увеличения содержания свободного кортизола в суточной моче, а в последующие 3-и и 5-е сутки он достигает нормальных значений.
Дифференциальная диагностика проводится с состояниями, сопровождающимися гиперпигментацией, слабостью, артериальной гипотензией, похуданием:
- Диффузный токсический зоб
- Общие признаки: слабость, похудание, пигментация.
- Отличия токсического диффузного зоба: артериальное систолическое давление повышено, а диастолическое снижено (увеличение пульсового АД), аппетит повышен, мелкий тремор пальцев рук, увеличение щитовидной железы, возможна мерцательная аритмия.
- Гемохроматоз
- Общие признаки: гиперпигментация, мышечная слабость.
- Отличия гемохроматоза: наличие цирроза печени, гипергликемия, повышение уровни железа в крови. Однако обязательно исследование кортизола крови, так как может быть сочетание гемохроматоза и гипокортицизма.
- Хронический энтероколит
- Общие признаки: слабость, похудание, боли в животе, гипотонии, анорексия.
- Отличия хронического энтероколита: частый жидкий стул, изменение копрограммы, сезонный характер обострения, эффект от ферментной терапии.
- Невротические синдромы
- Общие признаки: слабость, анорексия, тахикардия.
- Отличия: артериальное давление нормальное или отмечается его лабильность, нет пигментации и похудания, слабость в утренние часы и улучшение самочувствия вечером, непостоянство симптомов.
Лечение
Лечение основано на стимуляции синтеза собственных гормонов и заместительной гормональной терапии под контролем следующих параметров: АД, масса тела, цвет кожных покровов, уровень кортизола и кортикотропина, содержание калия и натрия в крови. Показана диета с повышенным содержанием углеводов (не менее 60%), достаточным количеством поваренной соли, белка и витаминов; общая калорийность пиши должна быть на 20-25% выше обычной.
Если удается достигнуть компенсации состояния (по указанным далее критериям) назначением аскорбиновой кислоты в дозе 1,5 до 2,5 г/сут, больные не нуждаются в постоянной гормональной терапии (обычно при латентной форме). В таких случаях стероидные гормоны (глюкокортикоиды) назначаются только на период стрессовых ситуаций (заболевание, тяжелая физическая нагрузка, нервное перенапряжение, хирургическое вмешательство).
В случае сохранения признаков болезни на фоне приема аскорбиновой кислоты назначаются гормоны с преимущественно глюкокортикоидной активностью, предпочтительнее натуральные — кортизон, кортизона ацетат. Доза кортизона ацетата подбирается индивидуально до достижения признаков компенсации (от 25 до 50 мг/сут).
Если не удается компенсировать состояние глюкокортикоидными гормонами, к лечению добавляют минералокортикоиды — кортинеф (флоринеф, 0,1-0,2 мг/сут). Необходимо избегать передозировки для предотвращения задержки жидкости и развития синдрома артериальной гипертензии.
Главное в заместительной терапии хронической недостаточности коры надпочечников — достижение и сохранение клинико-гормональной компенсации заболевания.
Критерии клинической компенсации:
- стабилизация массы тела;
- нормализация АД;
- устранение пигментации кожи и слизистых оболочек;
- восстановление мышечной силы.
Показатели гормонально-метаболической компенсации:
- базальный уровень кортизола плазмы > 350 ммоль/л;
- уровень калия — 4,0-4,5 ммоль/л;
- уровень натрия — 135— 140 ммоль/л;
- гликемия от 4,5 до 9,0 ммоль/л в течение суток.
Помимо заместительной терапии назначается этиопатогенетическое лечение, которое зависит от причины, вызвавшей болезнь.
При аутоиммунном генезе больные получают курсами 1—2 раза в год иммунокоррегирующие препараты для стимуляции Т-супрессорной функции клеточного звена иммунитета. С целью подавления антителообразования к ферменту 21-гидроксилазе периодически увеличивается доза глюкокортикоидов (особенно при интеркуррентных заболеваниях, когда повышается активность аутоагрессии).
При туберкулезной этиологии назначается специфическая противотуберкулезная терапия. В этих случаях контроль над ее продолжительностью и характером осуществляется врачом-фтизиатром. Показано назначение анаболических стероидов.
Источник: http://medicoterapia.ru/gipokortitsizm.html